
17年专业从事欧亚联盟EAC认证,俄罗斯GOST认证,乌克兰认证,权威
РАЗРАБОТКА, ВНЕДРЕНИЕ И ПОДДЕРЖАНИЕ СИСТЕМЫ МЕНЕДЖМЕНТА КАЧЕСТВА ПО ISO 13485
Согласно поправкам в 323-ФЗ «Об основах охраны здоровья граждан в РФ», принятым в 2021 году, производство медицинских изделий должно соответствовать требованиям к внедрению, поддержанию и оценке системы управления качеством медицинских изделий в зависимости от потенциального риска их применения.
Регистрация медизделий по требованиям ЕАЭС включает обязательное инспектирование производства, на предмет соответствия требованиям системы менеджмента качества (СМК) требованиям Решения Совета ЕЭК от 10.11.2017 года № 106.
Внедрение требований СМК также является обязательным для организаций, оказывающих услуги по техническому обслуживанию медицинской техники, в соответствии с Постановлением Правительства РФ от 30 ноября 2021 г. № 2129.
Наша компания предлагает полный спектр услуг в области разработки, внедрения и подготовке СМК Вашей организации к подтверждению соответствия в требуемой форме:
к сертификации на соответствие требованиям ГОСТ ISO 13485–2017 (в том числе для подтверждения соответствия лицензионным требованиям Постановления Правительства РФ от 30 ноября 2021 г. № 2129 к деятельности по техническому обслуживанию медицинских изделий);
к международной сертификации на соответствие требованиям ISO 13485:2016 (в том числе для СЕ-сертификации по регламентам (ЕС) 2017/745 MDR и 2017/746 IVDR);
к инспектированию в соответствии с требованиями Решения Совета ЕЭК от 10.11.2017 года № 106.
Комплексное внедрение системы менеджмента качества для целей сертификации на соответствие требованиям ISO 13485/ГОСТ ISO 13485 включает:
Предварительный (диагностический) аудит, планирование проекта;
Методическую подготовку (обучение) рабочей группы в форме семинаров/лекций;
Консультационную поддержку при регламентации бизнес-процессов и разработке документации;
Внедрение принципов риск-менеджмента (ISO 14971/ГОСТ ISO 14971), в том числе методическую подготовку (обучение) рабочей группы и редактирование файла менеджмента риска;
Методическую подготовку (обучение) внутренних аудиторов, проведение внутренних аудитов и опытную эксплуатацию СМК;
Анализ цикла СМК, корректировки и улучшения, планирование следующего цикла;
Подготовка к сертификации и сопровождение сертификации.
Для каждого клиента формируется индивидуальная программа внедрения системы менеджмента качества, в соответствии с его запросами и целями, подбираются наиболее подходящие инструменты для обеспечения эффективности работы системы.
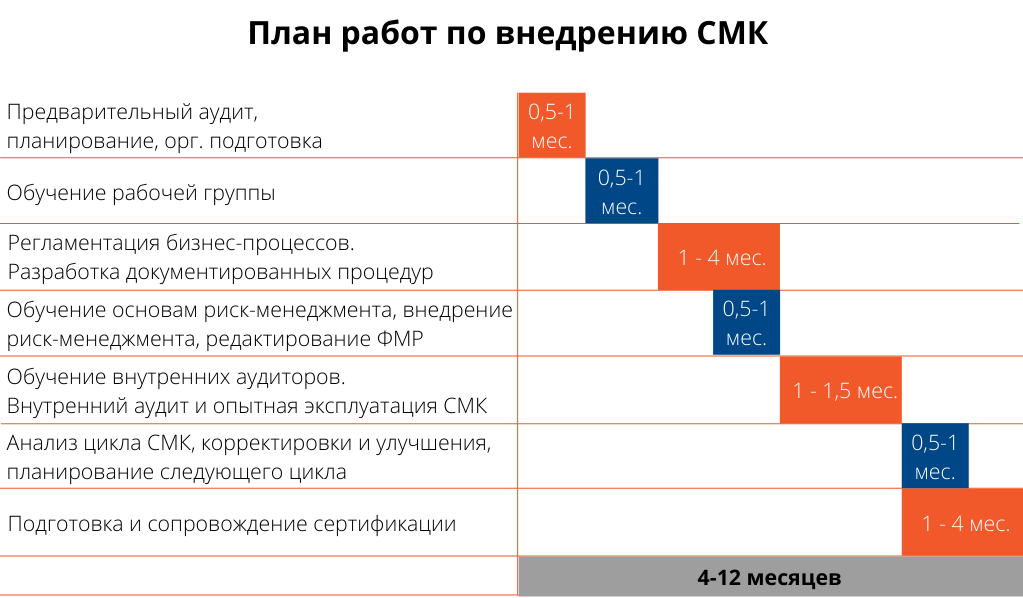
Сроки внедрения зависят от размера организации, особенностей ее функционирования, выбора сертифицирующего органа, а также степени вовлеченности клиента в процесс внедрения системы менеджмента качества. Внедрение СМК вместе с сопровождением сертификации может занимать от 4 до 12 месяцев, рекомендуемая продолжительность – 6 месяцев.
Для организаций, которым срочно требуется зарегистрировать медицинское изделие по правилам ЕАЭС, мы предлагаем программу интенсивного внедрения СМК.
Дополнительные услуги:
Аудит действующей СМК, подготовка рекомендаций по ее улучшению;
Описание и оптимизация существующих бизнес-процессов;
Методическая подготовка по основным принципам СМК по ISO 13485/ГОСТ ISO 13485;
Методическая подготовка по основам риск-менеджмента и пост-маркетинга;
Внутренний аудит предприятия и подготовка внутренних аудиторов Заказчика;
Разработка отдельных документов СМК;
Предсертификационный аудит;
Консультационная и методическая помощь в подготовке к сертификации;
Почасовые консультации ведущего эксперта по СМК.
Полезные видео по внедрению СМК на нашем Youtube-канале МедТехИндустрия
>> Наши клиенты >>
>> Портфолио >>
>> Отзывы и благодарности >>
СПРАВОЧНАЯ ИНФОРМАЦИЯ:
Презентация "Разработка и внедрение СМК на предприятиях медицинской промышленности"
ISO 13485 - это международный отраслевой стандарт, разработанный Международной организацией по стандартизации ISO. Целью стандарта в первую очередь, является повышение качества и безопасности продукции медицинского назначения.
Стандарт ISO 13485 является автономным, он может использоваться отдельно или совместно с другими стандартами систем менеджмента.
Приказом Федерального агентства по техническому регулированию и метрологии от 30 июня 2017 г. №615-ст межгосударственный стандарт ГОСТ ISO 13485 – 2017 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2018 г.
Стандарт ISO 13485-2017 устанавливает требования к системам менеджмента качества для компаний, деятельность которых связана с любым из этапов жизненного цикла медицинского изделия:
проектирование и разработка;
производство, включая поставку сырья или компонентов;
хранение, продажа и доставка;
монтаж, окончательный ввод в эксплуатацию и техническое обслуживание;
утилизация;
выполнение смежных услуг, связанных с производством, обращением или эксплуатацией медицинских изделий.
Инспектирование производства предусматривается в рамках процедуры государственной регистрации медицинского изделия, а также плановое и внеплановое. Внеплановое инспектирование возможно в случае нежелательных событий, связанных с угрозой причинения вреда здоровью и жизни граждан. Плановое инспектирование производится с определенной периодичностью.
Необходимо понимать, что в случае отрицательного решения по итогам внепланового и периодического инспектирования может стоять вопрос о приостановке, или прекращении производства и обращения медизделия. В зависимости от выявляемых проблем, можно будет устранить несоответствия и провести дополнительное инспектирование, уже в меньшем объеме.
В России проведение инспектирования производств возложено на Росздравнадзор.
联系我们:上海经合工业设备检测有限公司/俄罗斯EAC认证机构中国代表处
电话:021-36411223 36411293
邮件:gost@gost.org.cn
手机微信:18621862553
QQ:823786712
skype:gostchina


微信号 扫一扫联系我 公众号 扫一扫 关注我
24小时服务热线:
上海经合工业设备检测有限公司
021 36411223
EAC认证
乌克兰认证
哈萨克斯坦认证
乌兹别克斯坦认证
俄罗斯认证
版权所有:吉尔吉斯坦认证中心有限公司(上海中心),俄罗斯海关联盟认证中心,海关联盟认证,EAC认证,CU-TR认证,GOST认证
网站内容和图片版权所有,未经允许,不得转载复制拷贝和使用
版权所有 © 上海卡卢加机电设备检测中心 保留一切权利。

